Железо, свойства атома, химические и физические свойства.
Fe 26 Железо
55,845(2) 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Железо — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Расположен в 8-й группе (по старой классификации — побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Атом и молекула железа. Формула железа. Строение атома железа
Свойства железа (таблица): температура, плотность, давление и пр.
Физические свойства железа
Химические свойства железа. Взаимодействие железа. Химические реакции с железом
Таблица химических элементов Д.И. Менделеева
Атом и молекула железа. Формула железа. Строение атома железа:
Железо (лат. Ferrum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Fe и атомным номером 26. Расположен в 8-й группе (по старой классификации – побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Железо – металл. Относится к группе переходных металлов. Относится к чёрным металлам.
Железо обозначается символом Fe.
Как простое вещество железо при нормальных условиях представляет собой ковкий, вязкий металл серебристо-белого цвета с сероватым оттенком с высокой химической реакционной способностью. Собственно железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. На практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.).
Молекула железа одноатомна.
Химическая формула железа Fe.
Электронная конфигурация атома железа 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Потенциал ионизации (первый электрон) атома железа равен 762,47 кДж/моль (7,9024681(12) эВ).
Строение атома железа. Атом железа состоит из положительно заряженного ядра (+26), вокруг которого по четырем оболочкам движутся 26 электронов. При этом 24 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку железо расположено в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома железа на 3d-орбитали находится два спаренных и четыре неспаренных электрона. На внешнем энергетическом уровне атома железа – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома железа состоит из 26 протонов и 30 нейтронов.
Радиус атома железа (вычисленный) составляет 156 пм.
Атомная масса атома железа составляет 55,845(2) а. е. м.
Железо – один из самых распространённых в земной коре металлов – занимает четвертое место. Содержание в земной коре железа составляет 6,3 % (по массе). По этому показателю железо уступает только кислороду, кремнию и алюминию.
Изотопы и модификации железа:
Свойства железа (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Железо |
| 102 | Прежнее название | |
| 103 | Латинское название | Ferrum |
| 104 | Английское название | Iron |
| 105 | Символ | Fe |
| 106 | Атомный номер (номер в таблице) | 26 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, переходный, чёрный металл |
| 109 | Открыт | Известно с глубокой древности |
| 110 | Год открытия | до 5000 года до н. э. |
| 111 | Внешний вид и пр. | Ковкий, вязкий металл серебристо-белого цвета с сероватым оттенком |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 5 аллотропных модификации железа:
– α-железо (феррит) с кубической объемно-центрированной кристаллической решёткой и свойствами ферромагнетика, – β-железо с кубической объёмно-центрированной кристаллической решёткой, отличающееся от α-железа параметрами кристаллической решётки и свойствами парамагнетика. β-железо служит для обозначения α-железа выше точки Кюри (точка Кюри железа 769 °C), – γ-железо (аустенит) с кубической гранецентрированной кристаллической решёткой, – δ-железо с кубической объёмно-центрированной кристаллической решёткой, – ε-железо с гексагональной плотноупакованной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга* | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 6,3 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,11 % |
| 122 | Содержание в Солнце (по массе) | 0,1 % |
| 123 | Содержание в метеоритах (по массе) | 0,22 % |
| 124 | Содержание в организме человека (по массе) | 0,006 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 55,845(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d6 4s2 |
| 203 | Электронная оболочка | K2 L8 M14 N2 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 156 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 123 пм – low-spin,
152 пм – high-spin |
| 207 | Радиус иона (кристаллический) | Fe2+ low spin
75 (6) пм, Fe3+ low spin 69 (6) пм, Fe4+ low spin 72,5 (6) пм, Fe6+ low spin 39 (4) пм, Fe2+ high spin 92 (6) пм, Fe3+ high spin 78,5 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 26 электронов, 26 протонов, 30 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 8-ая группа (по старой классификации – побочная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1, +2 , +3 , +4, +5, +6 , +7 |
| 302 | Валентность | II, III |
| 303 | Электроотрицательность | 1,83 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 762,47 кДж/моль (7,9024681(12) эВ) |
| 305 | Электродный потенциал | Fe2+ + 2e– → Fe, Eo = -0,440 В,
Fe3+ + e– → Fe2+, Eo = +0,771, Fe3+ + 3e– → Fe, Eo = -0,037 В |
| 306 | Энергия сродства атома к электрону | 14,785(4) кДж/моль (0,153236(35) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность | 7,874 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело),
6,98 г/см3 (при температуре плавления 1538 °C и иных стандартных условиях, состояние вещества – жидкость), 6,9 г/см3 (при 1589 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1538 °C (1811 K, 2800 °F) |
| 403 | Температура кипения* | 2861 °C (3134 K, 5182 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 13,81 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 340 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,448 Дж/г·K (при 25 °C), 0,64 Дж/г·K (при 0-1000 °C) |
| 410 | Молярная теплоёмкость* | 25,10 Дж/(K·моль) |
| 411 | Молярный объём | 7,0923 см³/моль |
| 412 | Теплопроводность | 80,4 Вт/(м·К) (при стандартных условиях),
80,4 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
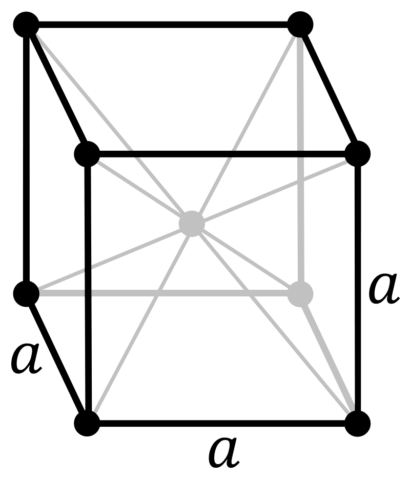
| 511 | Кристаллическая решётка #1 | α-железо (феррит) |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 2,866 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 460 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 511 | Кристаллическая решётка #2 | γ-железо (аустенит) |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 3,656 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 521 | Кристаллическая решётка #3 | δ-железо |
| 522 | Структура решётки | Кубическая объёмно-центрированная
|
| 523 | Параметры решётки | 2,93 Å |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | Im_ 3m |
| 527 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-89-6 |
Примечание:
205* Эмпирический радиус атома железа согласно [1] и [3] составляет 126 пм.
206* Ковалентный радиус железа согласно [1] составляет 132±3 пм (low-spin) и 152±6 пм (high-spin), ковалентный радиус железа согласно [3] [Россия] составляет 117 пм.
402* Температура плавления железа согласно [3] и [4] составляет 1538,85 °C (1812 К, 2801,93 °F) и 1539 °C (1812,15 К, 2802,2 °F) соответственно.
403* Температура кипения железа согласно [4] составляет 2870 °C (3143,15 К, 5198 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) железа согласно [3] и [4] составляет 13,8 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) железа согласно [4] составляет 350 кДж/моль.
410* Молярная теплоемкость железа согласно [3] составляет 25,14 Дж/(K·моль).
Физические свойства железа:
Химические свойства железа. Взаимодействие железа. Химические реакции с железом:
1. Реакция взаимодействия железа и углерода:
3Fe + C → Fe3C.
В результате реакции образуется карбид железа.
2. Реакция взаимодействия железа и кислорода:
3Fe + 2O2 → Fe3O4 (t = 150-500 °C),
2Fe + O2 → 2FeO,
4Fe + 3O2 → 2Fe2O3.
Первая реакция – это реакция сгорания железа на воздухе. Вторая реакция происходит при продувании воздуха через расплавленный чугун.В результате первой реакции образуется оксида железа (II, III), в результате второй – оксид железа (II), в результате третьей – оксид железа (III).
3. Реакция взаимодействия железа и красного фосфора:
Fe + 3P → Fe3P (t = 600-700 °C).
В результате реакции образуются фосфид железа. Так же образуются Fe2P, FeP, FeP2.
4. Реакция взаимодействия хлора и железа:
2Fe + 3Cl2 → 2FeCl3 (t = 250 °C).
В результате реакции образуется хлорида железа.
5. Реакция взаимодействия железа и серы:
Fe + S → FeS (t = 600-700 °C),
Fe + 2S → FeS2 (t = 689 °C).
В результате первой реакции образуется сульфид железа, в результате второй – дисульфид железа.
6. Реакция взаимодействия железа и фтора:
2Fe + 3F2 → 2FeF3 (t = 300 °C).
В результате реакции образуется фторида железа.
7. Реакция взаимодействия железа и брома:
2Fe + 3Br2 → 2FeBr3 (t°).
В результате реакции образуется бромид железа. В ходе реакции используется бром в виде насыщенного раствора. Реакция протекает при кипении.
8. Реакция взаимодействия железа и селена:
Fe + Se → FeSe (t = 600-950 °C).
В результате реакции образуется селенид железа.
9. Реакция взаимодействия железа и брома:
Fe + Br2 → FeBr2 (t = 600-700 °C).
В результате реакции образуется бромид железа.
10.Реакция взаимодействия железа и иода:
Fe + I2 → FeI2 (t = 500 °C),
3Fe + 4I2 → Fe3I8.
В результате первой реакции образуется иодид железа, в результате второй – иодида железа (II, III). Вторая реакция медленно протекает при растирании реакционной смеси.
11. Реакция взаимодействия железа и теллура:
Fe + Te → FeTe (t = 500 °C).
В результате реакции образуется теллурид железа. Реакция протекает при температуре 600-950°C.
12. Реакция взаимодействия кремния и железа:
2Si + Fe → FeSi2.
В результате реакции образуется силицид железа. Реакция протекает при сплавлении реакционной смеси.
13. Реакция взаимодействия железа, кремния и кислорода:
2Fe + Si + 2O2 → Fe2SiO4 (t = 1100-1300 °C),
2Fe + 2Si + 3O2 → 2FeSiO3 (t = 1100-1300 °C).
В результате первой реакции образуется ортосиликат железа, в результате второй – метасиликат железа.
14. Реакция взаимодействия железа, азота и лития:
Fe + N2 + 3Li → Li3FeN2 (t ≈ 600 °C).
В результате реакции образуется динитридоферрат лития.
15. Реакция взаимодействия железа и оксида углерода:
Fe + 5CO → [Fe(CO)5] (t = 150-200 °C).
В результате реакции образуется пентакарбонил железа. Порошок железа нагревается в струе CO при давлении 1·107-2·107 Па).
16. Реакция взаимодействия железа и оксида серы:
2Fe + 3SO2 → FeSO3 + FeS2O3
В результате реакции образуются сульфит железа и тиосульфат железа. В ходе реакции используется влажный оксид серы. Реакция медленно протекает при комнатной температуре.
17. Реакция взаимодействия железа и воды:
3Fe + 4H2O → Fe3O4 + 4H2 (t = 570 °C).
В результате реакции образуются оксид железа (II,III) и водород. Реакция протекает при температуре не более 570°C. Данная реакция является исторически первым способом получения водорода.
18. Реакция взаимодействия железа, воды и кислорода:
2Fe + 2H2O + O2 → 2Fe(OH)2.
В результате реакции образуется гидроксид железа. Реакция протекает медленно. Коррозия железа.
19. Реакция взаимодействия железа, воды, кислорода и оксида углерода:
2Fe + 2H2O + O2 + 4CO2 → 2Fe(HCO3)2.
В результате реакции образуется гидрокарбонат железа. Реакция протекает медленно.
20. Реакция взаимодействия оксида железа (III) и железа:
Fe2O3 + Fe → 3FeO (t ≈ 900 °C).
В результате реакции образуется оксида железа (II).
21. Реакция взаимодействия оксида железа (II, III) и железа:
Fe3O4 + Fe → 5FeO (t = 900-1000 °C).
В результате реакции образуется оксид железа (II).
22. Реакция взаимодействия оксида циркония(IV), углерода и железа:
ZrO2 + 2C + Fe → (Zr,Fe) + 2CO (t = 1400-1600 °C).
В результате реакции образуются ферроцирконий и оксид углерода.
23. Реакция взаимодействия железа, метагидроксида никеля и воды:
Fe + 2NiO(OH) + 2H2O ⇄ Fe(OH)2 + 2Ni(OH)2.
В результате реакции образуются гидроксид железа и гидроксид никеля – никель-железный гальванический элемент.
24. Реакция взаимодействия железа и азотной кислоты:
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O,
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O,
5Fe + 12HNO3 → 5Fe(NO3)2 + N2 + 6H2O (t = 0-10 °C).
В результате первой реакции образуются нитрат железа, оксид азота (IV) и вода, в результате второй – нитрат железа, оксид азота (II) и вода, в результате третьей – нитрат железа, азот и вода. В ходе первой реакции используется концентрированная азотная кислота, в ходе второй – 50%-й раствор азотной кислоты, в ходе третьей – очень разбавленный раствор азотной кислоты. В ходе четвертой реакции образуется также примесь – N2O, NH4NO3.
25. Реакция взаимодействия железа, азотной кислоты и кислорода:
4Fe + 12HNO3 + 3O2 → 4Fe(NO3)3 + 6H2O.
В результате реакции образуются нитрат железа и вода. Это промышленный метод получения нитрата железа.
26. Реакция взаимодействия железа и азотной кислоты:
В результате реакции образуются. В ходе реакции используется. Реакция взаимодействия железа и ортофосфорной кислоты:
4Fe + 3H3PO4 → FeHPO4 + Fe2(PO4)2 + 4H2.
В результате реакции образуются гидроортофосфат железа, ортофосфат железа и водород. В ходе реакции используется разбавленный раствор ортофосфорной кислоты.
27. Реакция взаимодействия железа и фтороводорода:
Fe + 2HF → FeF2 + H2.
В результате реакции образуются фторид железа и водород. В ходе реакции используется разбавленный раствор фтороводорода.
28. Реакция взаимодействия железа и бромоводорода:
Fe + 2HBr м FeBr2 + H2 (t = 800-900 °C).
В результате реакции образуются бромид железа и водород.
29. Реакция взаимодействия железа, гидроксида натрия и воды:
Fe + 2NaOH + 2H2O → Na2[Fe(OH)4] + H2 (t°).
В результате реакции образуются тетрагидроксоферрат натрия и водород. Реакция протекает при кипении раствора в атмосфере азота.
30. Реакция электролиза концентрированного водного раствора гидроксида калия и железа:
Fe + 2KOH + 2H2O → 3H2 + K2FeO4.
В результате реакции образуются феррат калия и водород.
31. Реакция взаимодействия железа, пероксида калия и воды:
Fe + 3K2O2 + 2H2O → K2FeO4 + 4KOH.
В результате реакции образуются феррат железа и гидроксид калия. Реакция медленно протекает в концентрированном растворе гидроксида калия.
32. Реакция взаимодействия железа и аммиака:
4Fe + 2NH3 → 2Fe2N + 3H2 (t = 350-550 °C).
В результате реакции образуются нитрид железа и водород. Так же образуются FeN, Fe4N.
33. Реакция взаимодействия хлорида меди и железа:
CuCl2 + Fe → FeCl2 + Cu
В результате реакции образуются хлорид железа и медь.
34. Реакция взаимодействия железа, гидроксида натрия, кислорода и воды:
4Fe + 20NaOH + 3O2 + 6H2O → 4Na5[Fe(OH)8] (t = 20-25 °C).
В результате реакции образуются октагидроксоферрат и натрий. В ходе реакции используется 50%-й раствор гидроксида натрия.
35. Реакция взаимодействия железа, гидроксида натрия, брома и воды:
2Fe + 14NaOH + 3Br2 + 2H2O → 2Na4[Fe(H2O)(OH)7] + 6NaBr (t = 50-60 °C).
В результате реакции образуются гептагидроксоакваферрат натрия и бромид натрия. В ходе реакции используется 50%-й раствор гидроксида натрия.
36. Реакция взаимодействия сульфида свинца и железа:
PbS + Fe → Pb + FeS (t = 1000 °C).
В результате реакции образуются свинец и сульфид железа.
37. Реакция взаимодействия железа и бензола:
18Fe + C6H6 → 6Fe3C + 3H2 (t = 700 °C).
В результате реакции образуются карбид железа и водород. Реакция протекает в вакууме.
38. Реакция взаимодействия железа, карбоната калия и серы:
6Fe + 4K2CO3 + 13S → 6K[FeS2] + K2SO4 + 4CO2 (t = 900-1000 °C).
В результате реакции образуются дисульфидоферрат калий, сульфат калия и оксид углерода.
39. Реакция взаимодействия железа, хлорида нитроила и воды:
2Fe + 6NO2Cl + 6H2O → 2FeCl3 + 6HNO3 + 3H2.
В результате реакции образуются хлорид железа, азотная кислота и водород.
40. Реакция взаимодействия железа, иодата натрия и пероксида водорода:
2Fe + NaIO3 + H2O2 → NaI + 2FeO(OH) (t°).
В результате реакции образуются иодид натрия и метагидроксид железа. Реакция протекает при кипении на воздухе.
41. Реакция взаимодействия сульфида сурьмы и железа:
Sb2S3 + 3Fe → 2Sb + 3FeS (t = 600-1300 °C).
В результате реакции образуются сурьма и сульфид железа. Сплавление реакционной смеси.
42. Реакция взаимодействия сульфида висмута и железа:
Bi2S3 + 3Fe → 2Bi + 3FeS (t = 1000 °C).
В результате реакции образуются висмут и сульфид железа.
43. Реакция взаимодействия хлорида сурьмы и железа:
2SbCl3 + 3Fe → 2Sb + 3FeCl3
В результате реакции образуются сурьма и хлорид железа. Реакция протекает в концентрированном растворе хлороводорода.
44. Реакция взаимодействия хлорида ванадия и железа:
3VCl4 + 4Fe → 3V + 4FeCl3 (t = 900 °C).
В результате реакции образуются ванадий и хлорид железа.
45. Реакция взаимодействия нитрата меди и железа:
Cu(NO3)2 + Fe → Fe(NO3)2 + Cu.
В результате реакции образуются нитрат железа и меди.
46. Реакция взаимодействия нитрата серебра и железа:
2AgNO3 + Fe → Fe(NO3)2 + 2Ag.
В результате реакции образуются нитрат железа и серебро.
47. Реакция взаимодействия железа и сульфата меди:
Fe + CuSO4 → FeSO4 + Cu.
В результате реакции образуются сульфат железа и медь.
Получение железа:
Применение железа:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Iron [англ.]
- https://de.wikipedia.org/wiki/Eisen
- https://ru.wikipedia.org/wiki/Железо
- http://chemister.ru/Database/properties.php?dbid=1&id=236
- https://chemicalstudy.ru/zhelezo-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
железо атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле железа
сколько электронов в атоме свойства металлические неметаллические термодинамические